アントラサイクリン系抗生物質(anthracycline antibiotics)は、がん化学療法に用いられる薬剤の一群であり、三つの作用機序 *1-3 によって多くの種類のがんに対して有効です。
その歴史は古く、特に1980年代にはドキソルビシン、ファルモルビシンなど天然・合成品の多くが見出されたが、心毒性の副作用のため有用性が制限され、現在臨床で使用されているものは殆どありません。
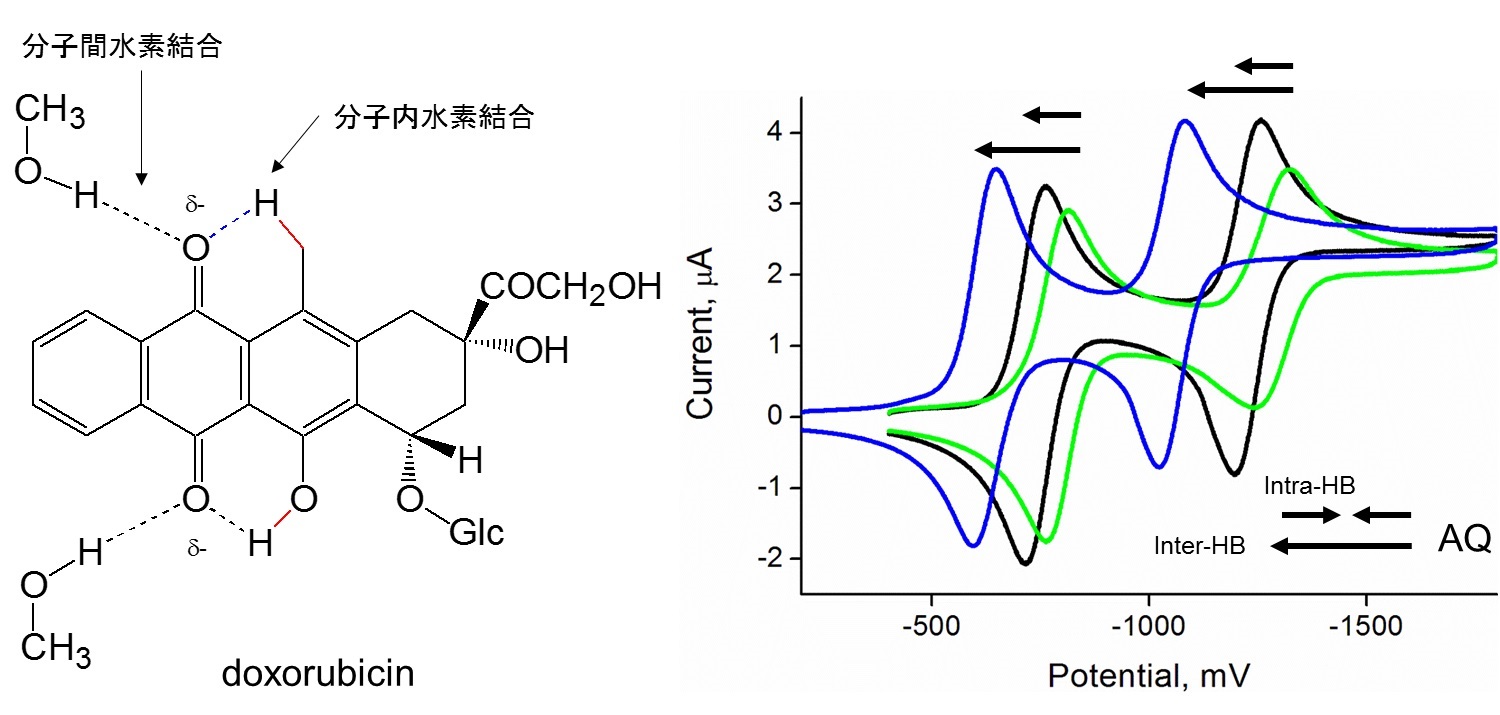
旧来より、作用機序は『DNA/RNA鎖の塩基対間へのインターカレーションによるDNA/RNA合成阻害』 *1 『II型トポイソメラーゼ阻害によるDNA転写およびDNA複製の防止』 *2 の二つが提唱されていましたが、近年、Ferroptosis *3 も有力であり、*1のインターカレーションと複合的に作用することで強力な抗がん活性を有すると考えられ、AQ骨格の電子移動とそれを制御する分子内水素の関係に関し大きな注目が集まっています(J. Elec -troanal.Chem., Gonzalez et.al., 600,345-358,2007; J.Am.Chem.Soc. Linschitz et.al. 119, 6384-6391, 1997)。
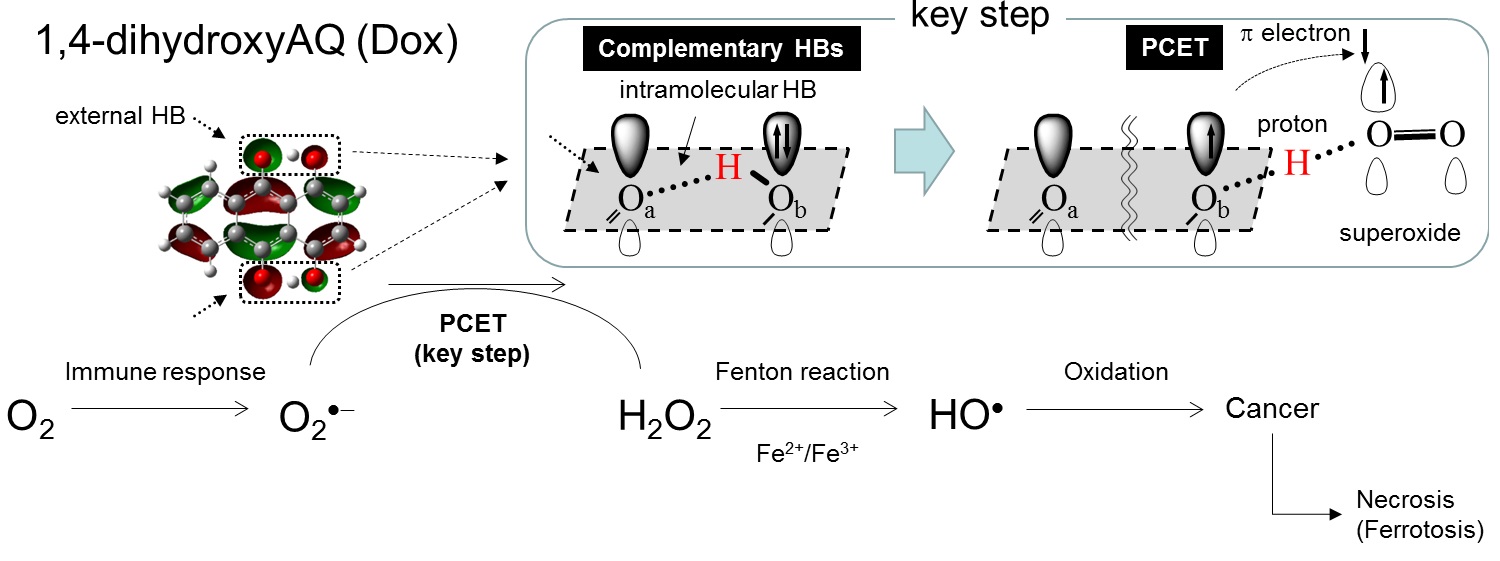
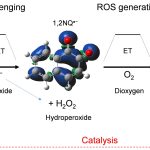
Ferroptosisのメカニズムは『鉄媒介酸素ラジカルを発生させ、がん細胞のDNA細胞膜を損傷させる』であり、アントラサイクリン系抗生物質の化学構造に基付く鉄媒介酸素ラジカル発生の電子移動メカニズムを明らかとすることが、重要な課題です。
しかし、アントラサイクリンの化学構造の中心であるアントラキノン(AQ)は、可逆な電子移動を担うキノン類の一つであり、酸素ラジカル発生のみならず、ラジカル消去作用も示し、酸化・還元の両方向の電子移動が可能です。
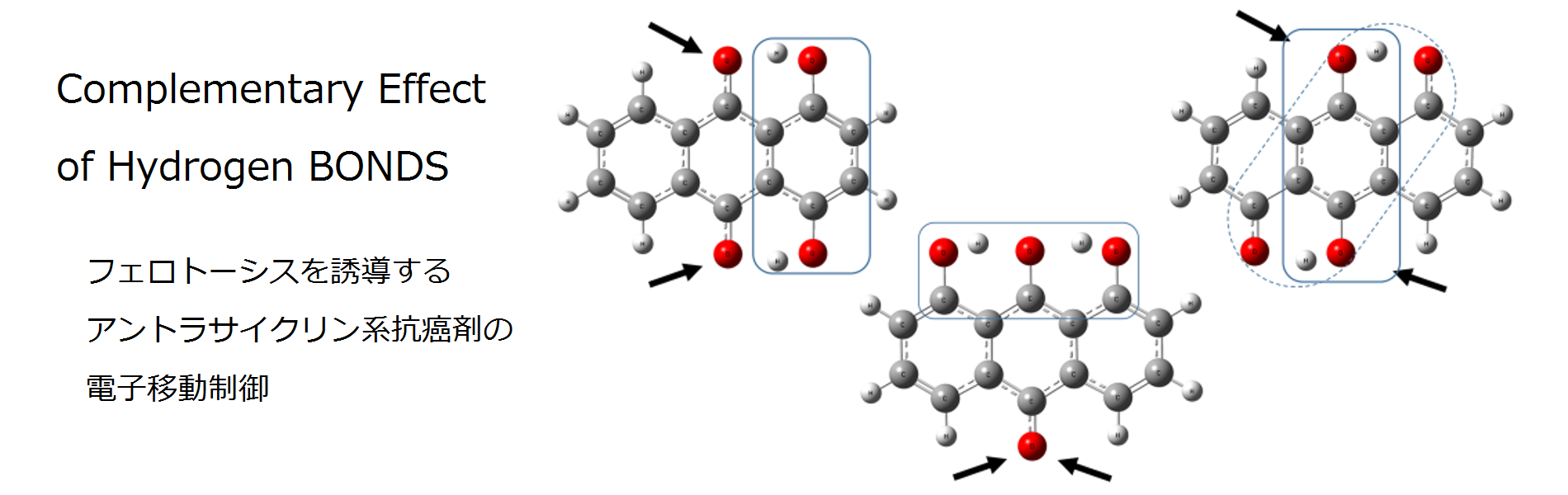
また、電子移動が水素結合により巧みに制御され、分子内水素結合が電荷移動、特に生体内の金属・活性酸素種への電子移動を制御していますが(Fig.1)、AQ類による直接的な酸素ラジカルの生成との関連を示すには至っていません。
本研究では、このAQ化学構造-Ferroptosis活性の物質論を明確化することで、副作用を低減し、作用を最大化する抗がん剤の開発を目指しています。
過去の関連文献
- Complementary Effect of Intra- and Intermolecular Hydrogen Bonds on Electron Transfer in β– Hydroxy-Anthraquinone Derivatives
- J. Phys. Chem. B, 2020, 124, 5, 848–860
- Tatsushi Nakayama, Noriko Okumura, and Bunji Uno (中山辰史、奥村典子、宇野文二)
- https://doi.org/10.1021/acs.jpcb.9b10733
- Reactivities of 1,2-, 1,3-, and 1,4- Dihydroxynaphthalenes toward Electrogenerated Superoxide in N,N-Dimethylformamide through Proton-coupled Electron Transfer
- Electrochimica Acta, 2022, 436, 141467
- Tatsushi Nakayama, Bunji Uno(中山辰史、宇野文二)
- https://doi.org/10.1016/j.electacta.2022.141467
- Study on Redox Properties and Cytotoxicity of Anthraquinone Derivatives to Understand Antitumor Active Anthracycline Substances
- Chem. Pharm. Bull., 2019, 67, 7, 717-720
- https://doi.org/10.1248/cpb.c19-00103
- Mechanistic Study on the Electrochemical Reduction of 9,10-Anthraquinone in the Presence of Hydrogen-bond and Proton Donating Additives
- Anal. Sci., 2012, 28, 3, 257-266
- https://doi.org/10.2116/analsci.28.257
- Aerobic Photooxidative Carbon–Carbon Bond Formation Between Tertiary Amines and Carbon Nucleophiles Using 2-Chloroanthra-9,10-quinone
- Synlett, 2014, 25, 10, 1453-1457
- https://doi.org/10.1055/s-0033-1341257
- Anti-Oncogenic gem-Dihydroperoxides Induce Apoptosis in Cancer Cells by Trapping Reactive Oxygen Species
- Int. J. Mol. Sci., 2016, 17, 1, 71
- https://doi.org/10.3390/ijms17010071