潰瘍性大腸炎およびクローン病は、大腸や消化管における非特異的炎症性腸疾患(Inflammatory bowel disease)であり、厚生労働省により難治性特定疾患(難病)に指定されています。1800年代に初めて症例報告されて以降の研究の歴史は古く、化学療法・疫学・病理、および食事療法・外科治療など、広い分野で重要な研究対象となっています。近年では、腸内細菌や自己免疫異常の関与が指摘され、免疫抑制剤や分子標的薬などの新薬の開発が望まれていますが、現在まで原因療法の確立には至っていません。
一方で、対処療法には、初期症状の緩解維持に効果のあるサラゾスルファピリジンが第一選択的に使用されてきました。このサラゾスルファピリジンは小腸で代謝され、5-アミノサリチル酸(5-ASA:5-aminosalicylic acid, 商品名:アサコール、ペンタサ、リアルザ)となって大腸で作用するプロドラッグです。この5-ASA はメサラジンとも呼ばれ、近年、その腸溶性製剤が開発されて、驚くべき効果をあげています。
しかし、パラアミノフェノール誘導体である5-ASAは、その単純な化学構造であるにも関わらず、科学的に反応機構は証明されていません。一般に抗炎症作用には、ステロイド系抗炎症薬による免疫抑制機構と、Cox阻害剤等の非ステロイド系抗炎症薬(NSAIDs)によるプロスタグランジン合成阻害機構が知られますが、5-ASAやアセトアミノフェンのようなパラアミノフェノール誘導体はいずれにも該当しません。また、サリチル酸系NSAIDsと似た構造を有しますがCox1、Cox2阻害作用は弱く解熱作用のみで抗炎症作用を有さないことが知られています。
他方で、5-ASAの基本的な投与量は1日1,500mg~8,000mgにおよび、多量の服用が患者の大きな負担となっています。一般的に、多量の投与量が必要な薬剤の作用機序は、酵素阻害のように少量で効くホルモン様作用ではなく、物質量に応じた化学的作用です。
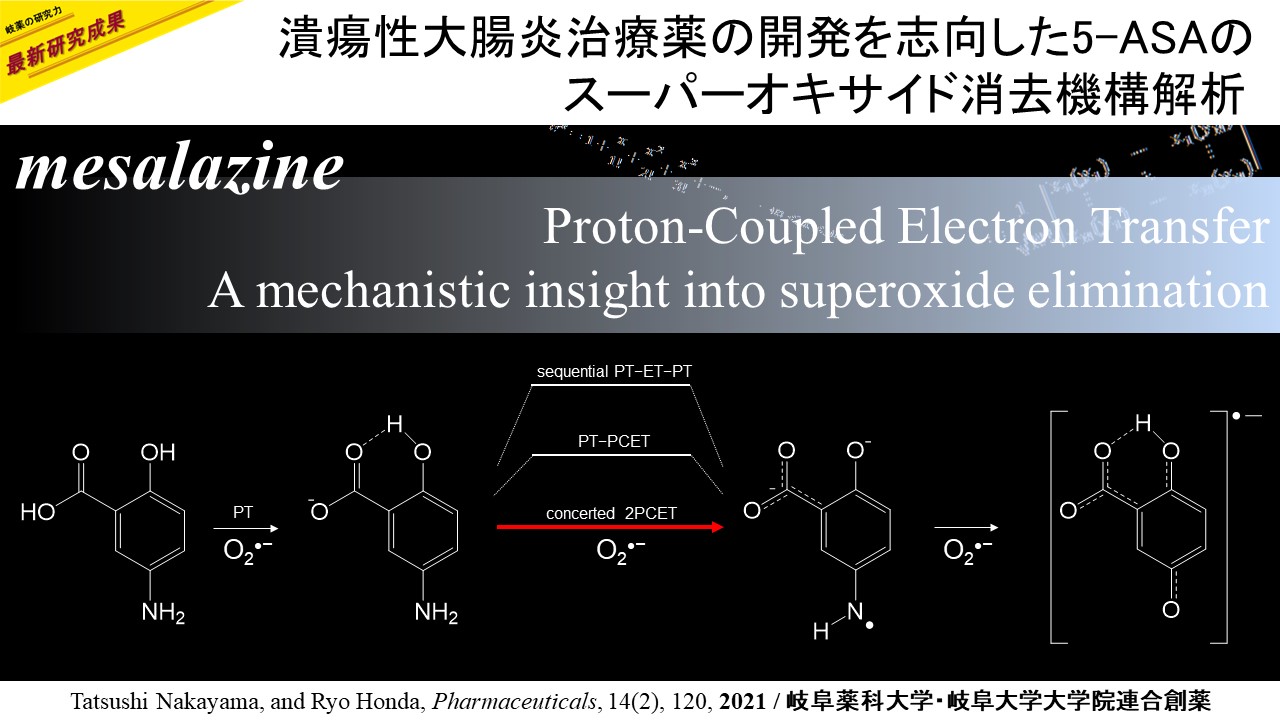
本研究では、この5-ASAの作用メカニズムが、腸管で直接的な活性酸素消去であるとの仮説を立て、その反応がプロトン電子共役移動反応(PCET)を介した還元的電子移動であることを明らかとしました(Figure 1)。この反応では、単独での電子移動は起こりませんが、プロトン移動との共役反応によって電子移動が許容されるエネルギー移動となる様子が解析されました。
また、塩基性の高い大腸で効率的な電子移動を担う構造―活性(物性)相関に関する知見が得られました。
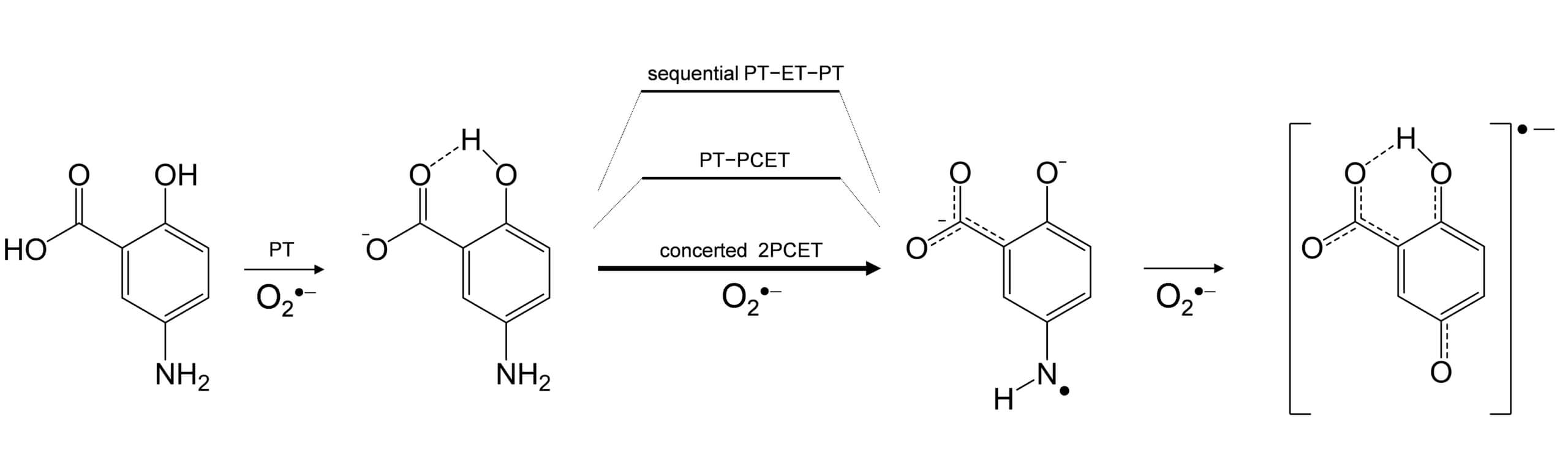
Figure 2に示したように電極上で生成させたスーパーオキサイドは、5-ASAとの間のプロトン移動が観測されますが、酸化的電子移動は、熱力学的にも速度論的にも、観測されません。しかしながら、最初の脱プロトンに伴う構造変化が、後続する協奏・共役的な電子移動としてラジカル化合物を生成する様子が、in situ型の電解ESR測定によって観測されました(Figure 3)。
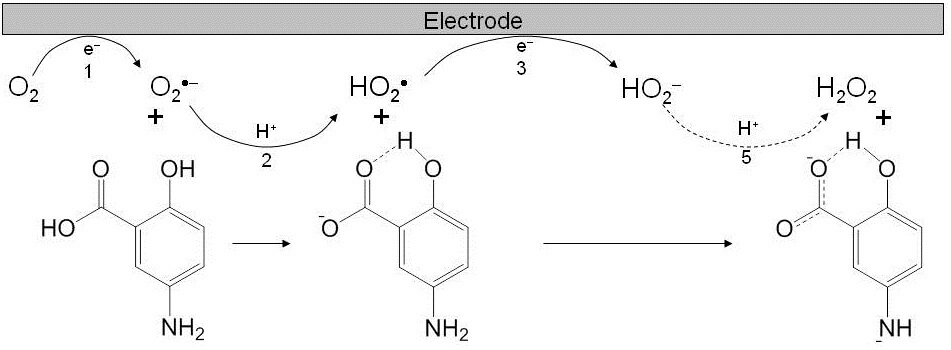
この結果を通じて、より効果のある治療薬開発に繋げることを目的とし、新薬開発に向けた研究への重要なヒントが得られました。
本研究成果のポイント
- 5-ASAによる活性酸素消去メカニズムが明らかとなった。
- 同メカニズムで多くの電子を供与できる新薬を設計し、潰瘍性大腸炎治療薬の投与量低減を目指す。
Future work
大腸内で、5-ASAによるPCETメカニズムを介したスーパーオキサイド消去は、熱力学・速度論的に理にかなったものです。更に薬効の優れた大腸炎治療薬を開発することは、この作用機序からは難しいと考えられます。
しかしながら、還元的電子数を増やして、1分子でより多くのスーパーオキサイドを消去する薬剤を開発することで、投与量を減らすことが可能であり、現在は、そのための理想的な分子をモデリングしています。
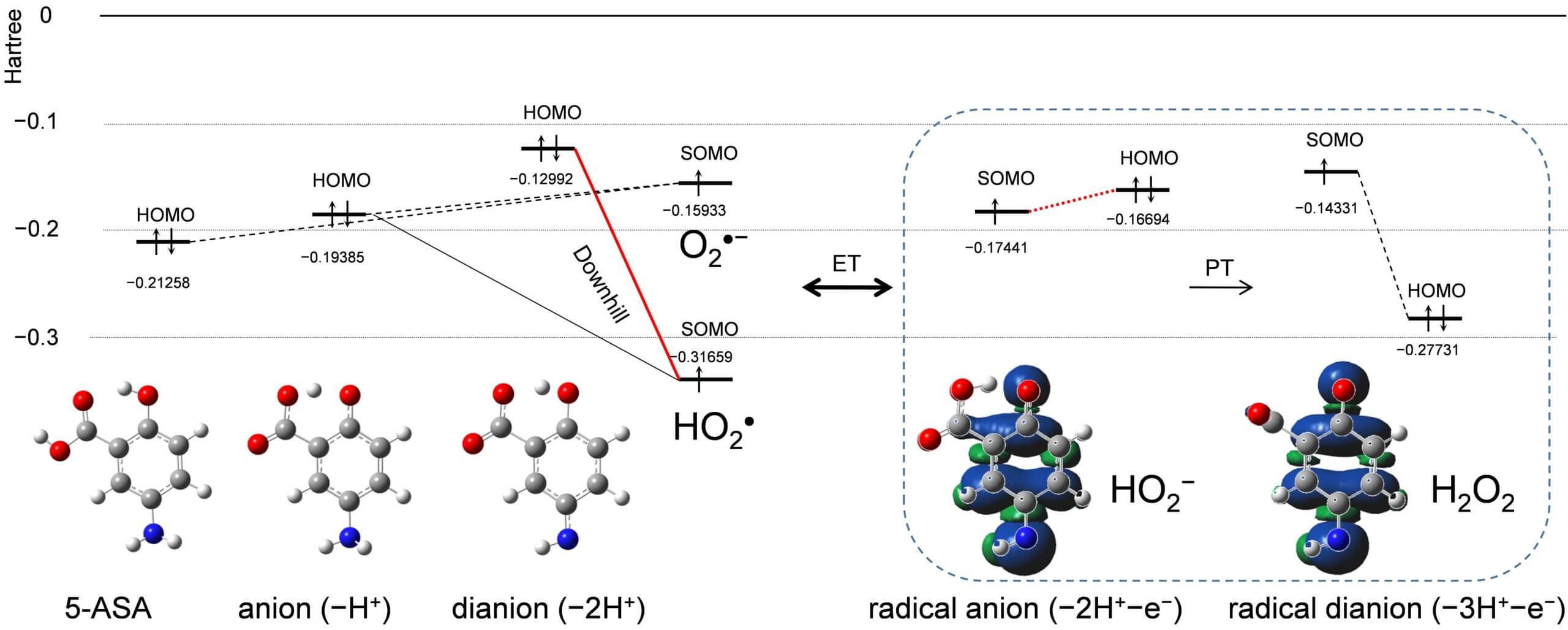
Figure 4で示した通り、5-ASAは脱プロトンに伴いアニオンとなると電子移動によってキノンイミド型のラジカルを生じます(PCET反応)。今回得た重要な知見は、さらに一分子のスーパーオキサイドが、キノンイミドの窒素原子と反応して、N-Oが交換したキノイドラジカルを生成する点です。
これにより、PCETを介したスーパーオキサイド消去だけでなく、後続のN-O交換による還元的電子移動も予測され、新規化合物モデリングにおいて複数のスーパーオキサイド消去が可能な分子構造として、同イミン骨格が重要なターゲットであると考えられます。
Papers
- Structural Properties of 4-Substituted Phenols Capable of Proton-Coupled Electron Transfer to Superoxide
- Int. J. Adv. Res. Chem. Sci. 2016, 3, 1, 11-19
- Tatsushi Nakayama, Bunji Uno (中山辰史、宇野文二)
- http://dx.doi.org/10.20431/2349-0403.0301002
- Electrochemical and Mechanistic Study of Superoxide Elimination by Mesalazine through Proton-Coupled Electron Transfer
- Pharmaceuticals 2021, 14(2), 120
- Tatsushi Nakayama, Ryo Honda(中山辰史、本田諒)
https://doi.org/10.3390/ph14020120 - Preprint 2020/12
https://www.preprints.org/manuscript/202012.0718/v1
- A Mechanistic Insight into Superoxide Elimination by Mesalazine through Proton-Coupled Electron Transfer
- T.Nakayama, R.Honda
- Current Aspects in Pharmaceutical Research and Development Vol. 5, 12–24, 2021
- DOI: doi.org/10.9734/bpi/caprd/v5/1626A


