概要(Oxidation of internal bonds of proteins)
『タンパク質の老化』を防ぐことが様々な老齢性脳疾患の治療薬開発に繋がるという信念の元、タンパク質の凝集・アミロイド化を誘導する酸化反応がどのように進行するのか?タンパク質のどの部分を酸化するのか? を明らかにしたいと考え、その中でも特に活性酸素種(Superoxide Anion Radical : SAR)と『タンパク立体構造を維持する分子内結合』の間の酸化的電子移動について分子論的に明らかとしたい。電気化学測定、酸化生成物の構造解析を通じ、脳タンパク質老化(酸化)と老齢性脳疾患の原因である神経回路破綻の関連を解明する一助となることを目標としている。
研究成果の概要
非水電気化学測定・量子化学計算を中心に、酸素より電気化学生成したスーパーオキサイドとタンパク質間の酸化反応挙動を観測した。電気化学測定で得られた電流電圧曲線を分析すると、タンパク質表面の酸化だけでなく、立体構造内部の複雑性や水和の状態が、反応電流値に大きく影響する様子が観測された。その結果の中で、含硫タンパク質が特徴的なESRスペクトルを示す様子が観測され、硫黄元素とスーパーオキサイドのラジカル付加反応、プロトンと電子の共役移動反応(proton-coupled electron transfer)が、タンパク質の立体構造破綻の要因である可能性が示唆された。
We observed the homogeneous-oxidation of some proteins by electrogenerated superoxide radical anion, using non-aqueous electrochemical measurements and quantum chemical calculations. Analysis of the current-voltage curve obtained by electrochemical measurement revealed that not only the oxidation of the protein surface but also the complexity inside the three-dimensional structure and the state of hydration greatly affects the reaction current value. In the results, it was observed that the sulfur-containing protein showed a characteristic ESR spectrum, demonstrating that the two mechanisms, the radical adduct formation and the proton-coupled electron transfer between sulfur element and superoxide, may be the cause of the collapse of the three-dimensional protein structure.
研究分野:
薬学、電気化学、計算化学、量子化学
キーワード
ラジカル付加反応、プロトン電子共役移動反応、含硫タンパク質、π共役軌道、タンパク質立体構造
研究成果の学術的意義や社会的意義
当研究では、活性酸素種によるタンパク質の酸化が、タンパク質の凝集やアミロイド化に繋がるとの推論から、どのような化学反応メカニズムで起こりうるのか、その真理を探ることで、タンパク質の酸化理論の確立に貢献したい。これにより、タンパク質の新たな解析手法の開発、アルツハイマー症候群やパーキンソン病等の老齢性脳神経障害の治療薬開発などに寄与する情報を得られることから、学術的意義だけでなく、医療・薬学分野での応用に関連した社会的意義を有する。
1. 研究開始当初の背景
(1) 長寿社会において、アルツハイマー病(Alzheimer’s disease : AD)やパーキンソン病(Parkinson's disease : PD)などの老齢性脳神経疾患は、医学・薬学・予防科学上の重要な研究対象となっている。近年の病理研究では、膜貫通タンパク質の分解産物「アミロイドβ: Aβ」の異常凝集・蓄積が脳神経障害を引き起こすことから、脳内タンパク質の代謝物・分解物による神経の物理的障害が病因であることが証明されつつある。AD 脳病変の特徴として神経細胞の変性消失とそれに伴う大脳萎縮、老人斑の多発、神経原線維変化の多発の三つがあり、1980 年代に老人斑が Aβの凝集蓄積であることが明らかとなって以降、その産出の上昇と分解不全によるAβ蓄積を開始点とするアミロイドカスケード仮説(Luxiang Cao, Nature comm., 3, 1006, 2012)が最も支持されている病因である。しかしながら、このアミロイドの産出上昇と分解不全の原因は“タンパク質の立体構造破綻”が関与していると考えられ、制御することは難しい。タンパク質の立体構造破綻は、加齢に伴う『タンパク質の老化』であり、物質論的には活性酸素種によるタンパク質の化学酸化が構造破綻を引き起こすことに起因すると考えられる。巨大な分子であるタンパク質の酸化について、どの構造・構成アミノ酸やペプチドが酸化されると立体構造破綻に結びつくのか、その酸化機構を化学的に証明することは難しい。近年、タンパク質科学の研究領域は拡大し、アミノ酸やドメイン単位の合成・制御が可能となったことから、Aβの酸化可能性のあるドメインについて、組み換えタンパク質と電気化学測定を用いた検証が展開され(E.V.Suprun, Electrochem. Comm., 65, 53-56 2016、T.A.Enache, Bioelectrochemistry, 114,13-23 2017)、易酸化性のアミノ酸配列(一次構造)について報告されている。しかし、αヘリックスやβシートのようなタンパク質立体構造を維持するのは特定のアミノ酸ではなく、立体構造内部に形成している水素結合やジスルフィド結合であるため、真に評価するべき凝集に直結するタンパク質内部の酸化的電子移動過程は明らかとされておらず、そのための新手法開発が望まれている。他方で、脳内の抗炎症(抗酸化)作用が AD/PD の亢進を遅らせるとする臨床研究(n Engl, J Med 345,1515-1521 2001)が報告され、炎症部位に発生する酸素化学種の作用が興味深い。これは『タンパク質の老化』の主因子が、活性酸素種による化学酸化であることを裏付けており、活性酸素種によるタンパク質の酸化機構は、老齢性脳神経疾患の創薬研究における重要なターゲットとなり得る。
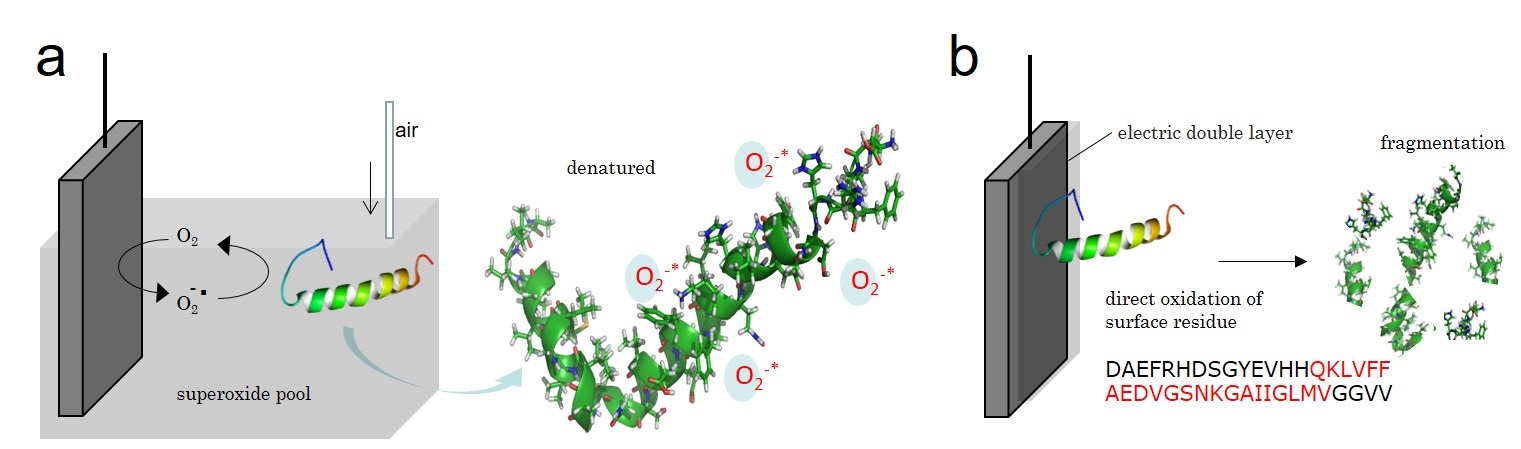
(2) タンパク質酸化還元挙動の解析は電気化学研究者の長年の課題となっているが、立体構造の複雑さと分子サイズの大きさから、電極による直接酸化に意義を見出すことは難しい。この電極酸化では、立体的なタンパク質の表面のみが酸化され、立体構造破綻と凝集に繋がる分子内部の酸化は観測できない。そのため、タンパク質の凝集に繋がる立体構造内部の酸化は、電極での直接酸化ではなく、タンパク質内部を化学種により酸化し、電極で間接的に酸化電流を測定する手法により観測し得る。このような背景の元、本研究では生体内の活性酸素種である superoxide anion radica(SAR, O2•−)を用いて、タンパク質の立体構造内部の酸化について検証する(Fig.1)。
2.研究の目的
本研究では、活性酸素種によるタンパク質内部結合の酸化が、タンパク質の老化と呼ばれる立体構造破綻とアミロイド化にどのように関連するのかを明らかとしたい。上述のアミロイドカスケード仮説では、アミロイドタンパク質の算出上昇と分解不全が老齢性脳神経疾患を引き起こすとされるが、本研究もこの仮説を支持し、その中で Aβの分解不全に繋がるようなタンパク質の酸化について、そのメカニズムを明らかとする基礎研究に位置づけられる。本研究のように、アミロイド化やタンパク質の変異メカニズムとして、酸化損傷、活性酸素が関与する可能性に言及する症例研究や in vivo 研究は散見されるものの in vitro の研究報告は少なく、特にタンパク質内部結合の酸化を物質論的に解析した研究は見つからない。そこで本研究では、電極で酸素より生成させた SAR とタンパク質の反応性を解析し、以下を明らかとすることを具体的な目的とした。
- タンパク質分子内部の酸化的電子移動過程を評価する手法の確立
- タンパク質の酸化と立体構造変化の関係性の解明
- 凝集性獲得に及ぼすタンパク質内部酸化の影響の評価
3.研究の方法
電気化学測定、電解分光測定、量子化学計算等の、化学分析手法を用いて、SAR とタンパク質の反応性を解析し、タンパク質の内部酸化に関連する知見を得る。
(1) タンパク質の SAR 酸化における電子移動解析
様々な溶媒や支持電解質、多様な電気化学測定モードを用いて、SAR とタンパク質間の反応を多面的かつ精密に解析する。酸素の cyclicvoltammetry(CV)では、電極で酸素より生成させたSAR とタンパク質との間の電子移動(Fig.1a)は、EC 反応(Electro-Chemical)或いは ECE反応(Electro-Chemical-Electro)を示す電流電圧曲線として観測される。電極と目的タンパク質の直接の電子移動(Fig.1b)を観測するのではなく、生体内活性酸素種である SAR を電極で生成させてタンパク質に加え、SAR 消費量の減少から間接的にタンパク質酸化を評価する。複数のモデルタンパク質を用い、評価手法を確立する。非水サイクリックボルタンメトリー法で得られた電流-電圧曲線を解析し、従来の手法との比較検討を以って、タンパク質内・外の酸化電位・酸化電子数を明らかとする。
(2) 酸化生成物の解析
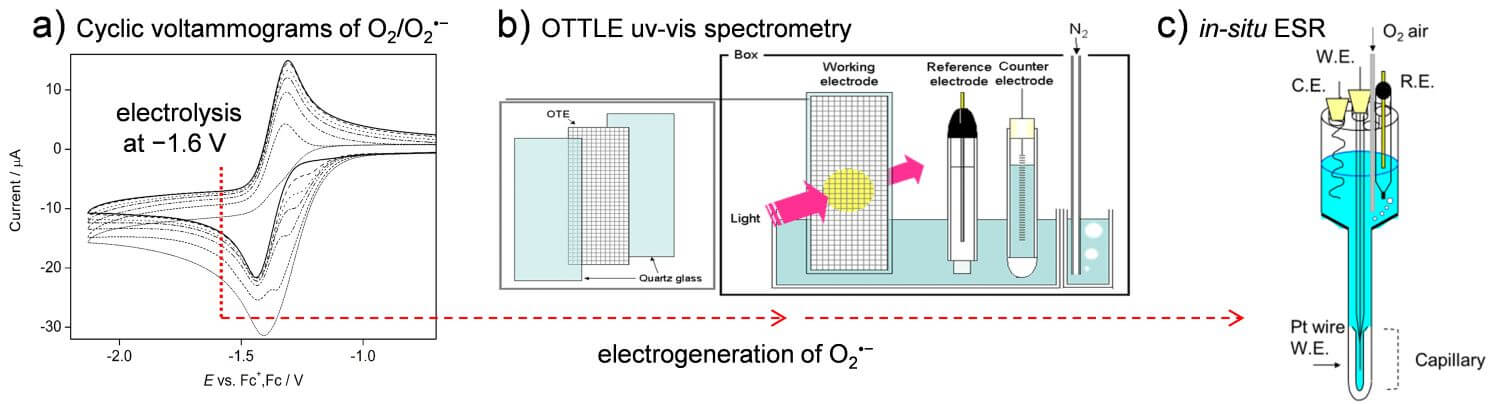
反応溶液中の酸化生成物について、紫外可視吸光法(UV-vis)/円二色偏光(CD)/電子スピン共鳴法(ESR)/質量分析(MS)等の各種スペクトルを測定・解析することで、酸化的電子移動後の複雑な後続反応を予測する。特に酸化電子数や SAR の消費量に対応した構造変化を in situ 型の電解分析セル(Fig.2)を用いて解析し、タンパク質のアンフォールディングやラジカル付加反応等が引き起こす α ヘリックス構造の破綻を観測する。
(3) 量子科学計算による反応予測(反応経路解析、軌道エネルギー計算)
反応全体を計算科学的に解析することは難しいため、まずは非断熱的(垂直型)電子移動により生成する酸化体の軌道エネルギー・自由エネルギーを算出する。その後、コンフォーメーション変化と反応経路について分析測定の結果と比較し、予測の妥当性を検証する。
(4) 凝集性(脳神経毒性)の確認・解析生成物の粒度分布測定(DLS)・タンパク質凝集測定アッセイ(蛍光)により凝集性を確認する。
(5) 生体タンパク質試料の解析・創薬に繋がる可能性の検討
モデルタンパク質で確立した手法で、A40、A42(アミノ酸残基 40、42 のヒト由来 A)、並びに A前駆体膜貫通タンパク質の酸化・構造変化・凝集性を解析し、脳神経毒性と酸化の関連に言及する。
4.研究成果
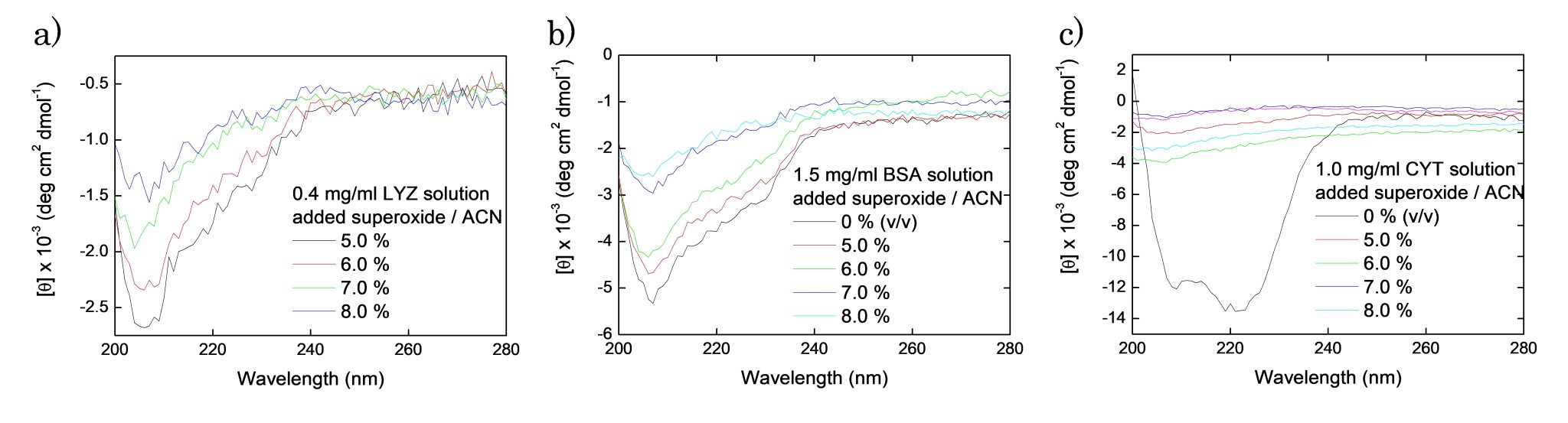
(1) 3 種類のモデルタンパク質(hen egg-white lysozyme: LYZ, bovine serum albumin: BSA, cytochrome C: CYT)について、溶液中でバルク電解酸化して CD スペクトルを測定すると、αヘリックス構造の有意な減少を示し(アンフォールディング)、また DLS と MS の測定結果は、タンパク質の高次構造(二次-四次構造)だけではなく、一次構造(アミノ酸配列)を分断している様子を示した。この結果は、電極での直接酸化が、タンパク質表面のアミノ酸を酸化してフラグメント化し、高次構造を維持する内部結合の酸化は観測出来ないことを示唆した。一方で、電極で酸素より生成させたO2•−と反応させると、一次構造は分断されず、CD スペクトルが変化する様子を示した(Fig.3)。このことは、低分子であるO2•−が、巨大なタンパク質の分子構造内部に移送し、酸化的電子移動によりタンパク質の分子内結合(分子内水素結合やジスルフィド結合)と反応して、高次構造が変化したことを示唆している。更に、凝集性ペプチド鎖である herix-2、amiroid-beta42 は、SAR 酸化の前後でアミロイド形性能(β シート化)が変化する様子を観測した。つまり、タンパク質内部結合の酸化的電子移動が始反応となり、凝集性を始めとするタンパク質の機能性が破綻することを示し、“タンパク質の老化(一次構造の変化を伴わない機能性の低下)”が構造内部の化学酸化に基づくことを示唆する結果となった。
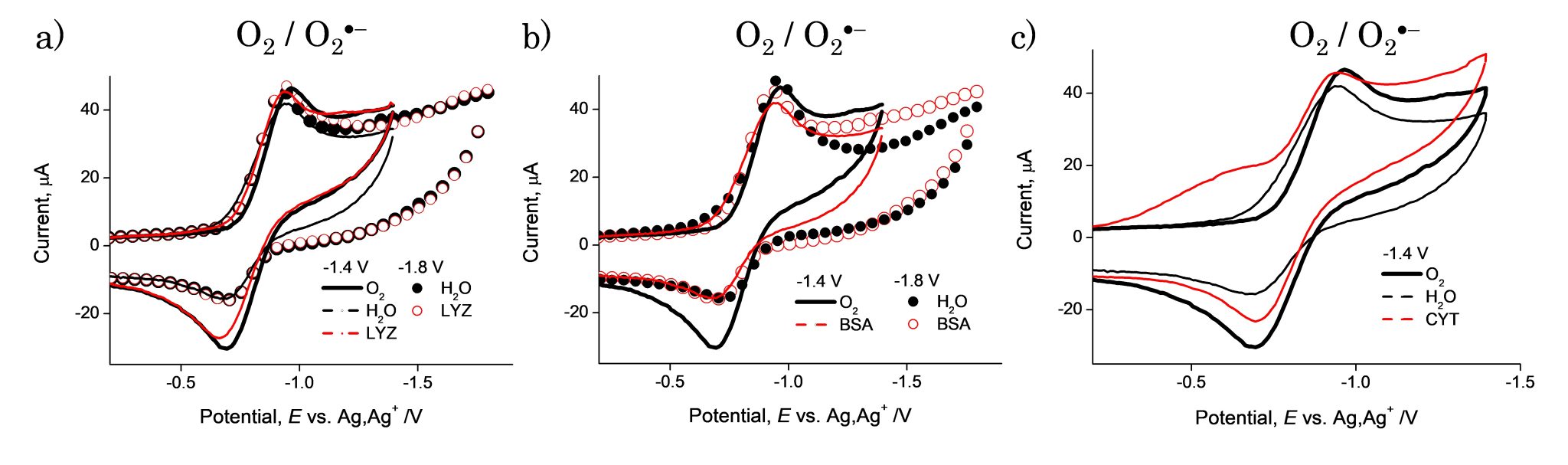
(2) DMF 溶液中に三種類のモデルタンパク質を加えて O2/O2•−の CV を測定し、電解生成したO2•−とタンパク質間の電子移動を観測した(Fig.4)。O2•−はタンパク質アミノ酸側鎖のプロトンを受け取り、ヒドロペルオキシラジカル(HO2•)となって、さらに電極でもう一電子還元される様子が、O2/H2O2の二電子還元を示す ECE 反応として観測される。その過程で、HO2•とタンパク質の間の電子移動が後続すると、二電子還元の ECE 反応を示さず、プロトン移動のみの不可逆な一電子反応である EC 反応が観測される。ここでは、水を加えた場合(プロトン移動しか示さない ECE 反応)と比較することで、電子移動の有無を判別した。観測された CV では、各タンパク質で、反応性が異なることが明らかとなった。LYZ 共存下では CV の可逆性は保たれていることから(a)、O2•−との反応性が低く、プロトン移動および後続する電子移動も確認されなかった。次に、BSA 共存下では(b)、CV は不可逆な EC 反応となり、プロトン移動と後続する HO2•を不活性する様子が観測された。また CYT 共存下では(c)、CV の前置波が観測され、CYT と O2・O2•−の水素結合が ECE 反応を起こすことを示した。この結果は、各タンパク質の構造が O2 やO2•−による酸化に大きく影響し、特に電子移動の前反応である水素結合の形成やプロトン移動、タンパク質の溶解性が、その反応性に大きく影響していることが示唆された。
(3) Fig.4a で観測された EC 反応では、HO2•を不活性する反応が後続している。HO2•は高い求電子性(強い酸化力)を有する活性酸素種であるため、タンパク質の酸化に伴う電子移動反応が後続することが予想される。タンパク質立体構造の形成に関与する分子内水素結合は、O2•−のブロンステッド塩基としての反応性によって脱プロトン化されて立体構造が破綻すると共に、後続電子移動による酸化作用で、不可逆的なタンパク質の変性を起こすことが予想される。このプロトン移動と後続する電子移動反応は、共役的に進行するプロトン電子共役移動反応(proton-coupled electron transfer : PCET)メカニズムで進行する。この PCET 反応は、タンパク質の各構成アミノ酸の平面性が大きく作用し、アミノ酸の水酸基・アミノ基とO2•−との間の主要な酸化メカニズムであると推察される。他方で、アミノ基・カルボキシル基以外の特性を示す構成アミノ酸に含硫アミノ酸があり、タンパク質中でジスルフィド結合を形成することが知られている。O2•−と含硫アミノ酸との反応において、酸化的電子移動がジスルフィドを形成するが、形成されたジスルフィドに対しては反応しないため、タンパク質立体構造内のジスルフィドへの影響は不明である。この点を解明するために、チオール化合物、二つのチオールを持つbenzenethiol とO2•−との反応を解析した(Fig.5)。チオールとO2•−の反応が CV 及び電解ESR により確認され、硫黄元素へのラジカル付加反応が進行することが明らかとなった。しかし、π共役性を有する 1,4-dibenzenthiol は、ラジカル付加ではなく PCET 反応と後続するアミノ基との結合反応が確認された。この結果より、タンパク質中のチオール基の構造に基づく二つの反応性;ラジカル付加反応、PCET 反応を介したアミノ窒素との付加反応、が観測され、いずれかが進行することが明らかとなった。同様の反応が、アミノ酸中のチオール・ジスルフィド結合に対して進行することが予想され、タンパク質の立体構造破綻を引き起こす内部結合の酸化が、チオール・ジスルフィドを対象に進行する反応であることが明らかとなった。
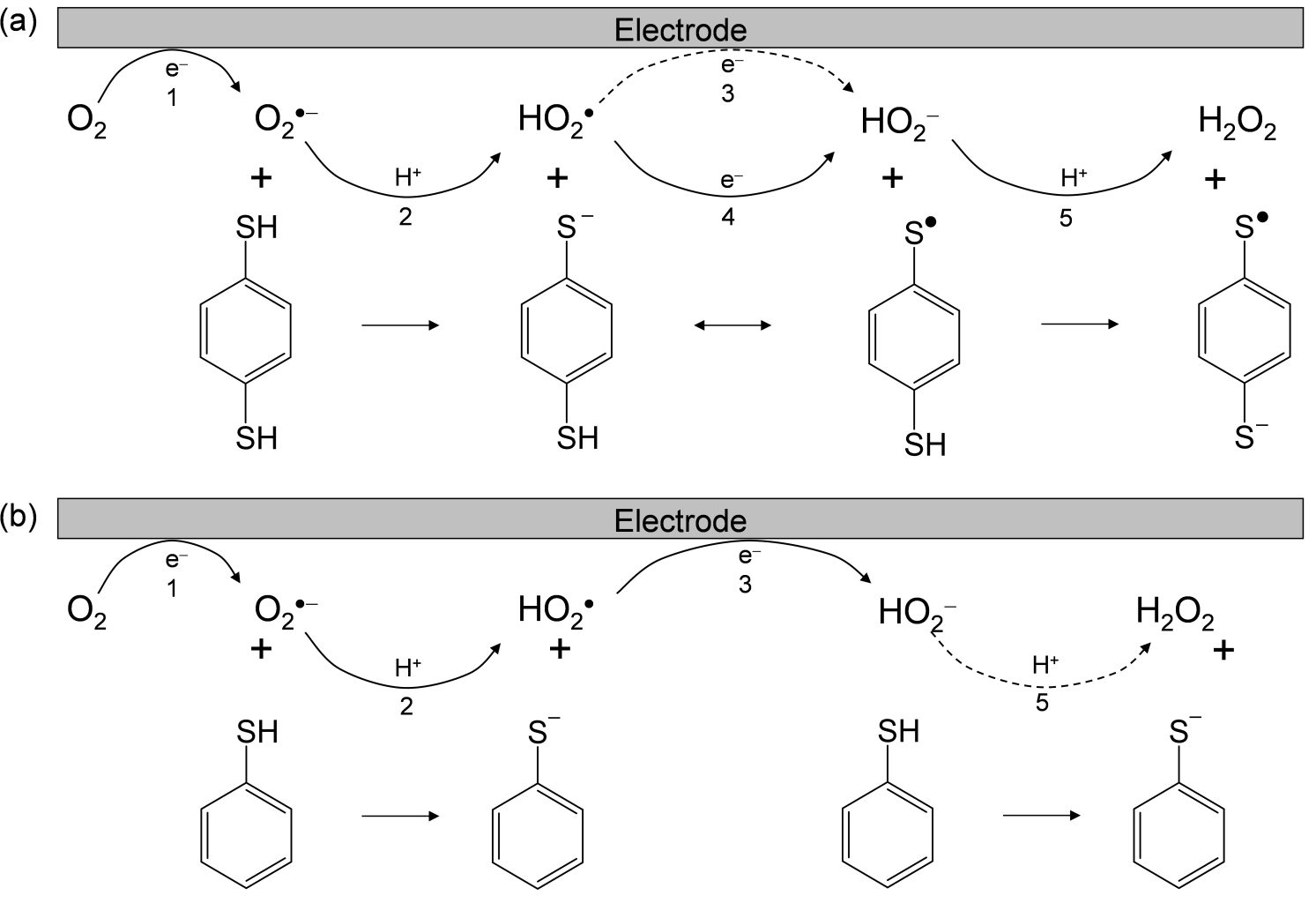
以上の結果より、老齢性脳疾患を引き起こす脳内タンパク質の酸化・アミロイド形成・凝集は、含硫アミノ酸の PCET 反応やジスルフィド形成が大きく影響することが示唆される結果となった。


